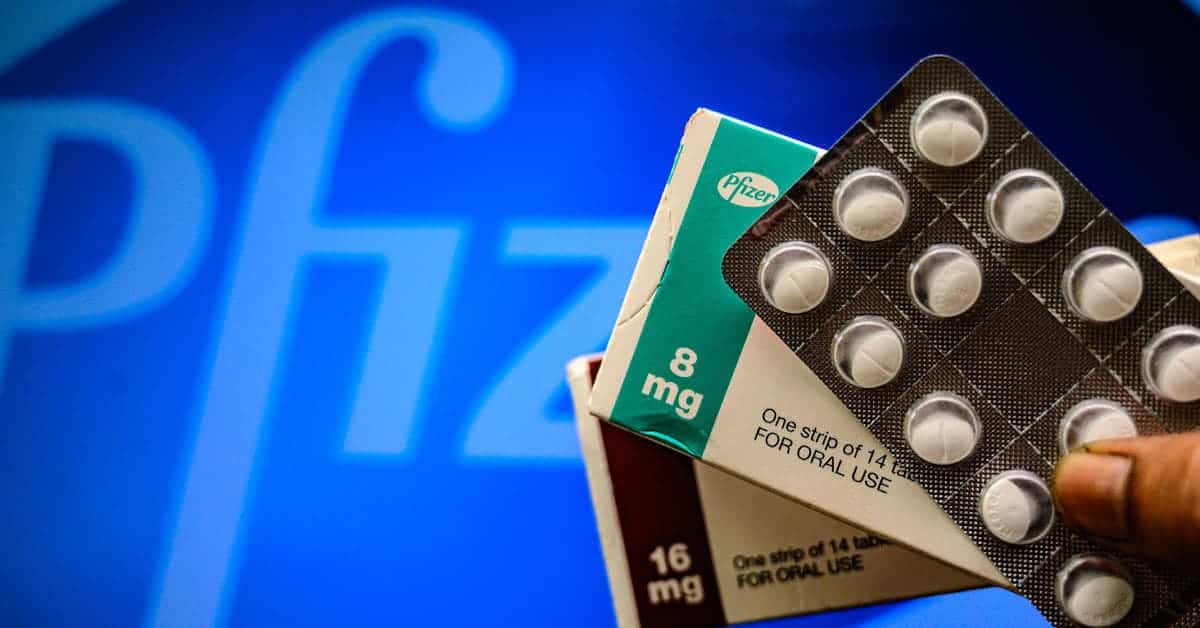
- Las farmacéuticas Pfizer y Meck anunciaron la creación de sus respectivos medicamentos de uso oral para combatir los síntomas y prevenir el riesgo de hospitalización. Aunque las autoridades sanitarias aún evalúan su seguridad, su aprobación significa, junto a la vacunación, un avance en la reducción de la mortalidad del virus
Cerca de cumplirse dos años desde la aparición de los primeros casos registrados de covid-19 en China, el mundo parece mucho más preparado para atender la pandemia. Actualmente se estima que 3.120 millones de personas poseen las dos dosis de la vacuna, lo que representa cerca del 39,9% de la población mundial. Aunque el proceso va lento, ahora se suma un nuevo componente para ayudar a reducir los índices de mortalidad por el virus: los medicamentos de uso oral.
Recientemente Pfizer, coresponsable de una de las vacunas más efectivas contra el covid-19, anunció el desarrollo de una píldora para tratar los síntomas de la enfermedad. Asegura que puede reducir considerablemente el riesgo de muerte u hospitalización. El fármaco, de nombre paxlovid, completó la tercera fase de ensayos con un 89% de eficacia en sus estudios preliminares. Esto de acuerdo a una comunicado de la propia empresa.
Pfizer se une a la estadounidense Merck, Sharp y Dohme (MSD) en una nueva etapa de tratamiento del covid-19 usando píldoras convencionales. El 4 de noviembre de 2021, MSD recibió la autorización del Reino Unido para el uso en caso de emergencia de su propio antiviral, el molnupiravir. Actualmente busca también la aprobación de los entes reguladores de Europa y Estados Unidos.
¿En qué consisten estos medicamentos?

En un principio, las pastillas contra el covid-19 buscan que el paciente las ingiera apenas manifieste los primeros síntomas, de la misma manera que lo haría con un antigripal. De hecho, precisamente el molnupiravir fue desarrollado inicialmente para tratar la gripe antes de descubrirse su efectividad contra el coronavirus.
El fármaco de MSD se compone por un derivado del nucleósido sintético N4-hidroxicitidina, el cual ataca las enzimas del virus SARS-CoV-2, responsable de la enfermedad. El activo induce errores de copia durante la replicación del ARN del virus, lo que le impide seguir reproduciéndose. El paxlovid funciona con un principio similar al evitar la replicación del virus, solo que bloqueando directamente la actividad de la enzima. Esto mediante un compuesto denominado PF-07321332, diseñado para inhibir la proteasa (la enzima) durante la etapa de proteólisis, justo antes de la replicación del ARN.
Ambos antivirales aseguran haber completado con éxito las tres fases de ensayos clínicos, sin muertes ni efectos secundarios en los pacientes. En el caso de Pfizer, suministró su producto a 389 personas contagiadas de covid-19 y sin vacunar, y lo comparó con otras 385 que recibieron un placebo. Luego de 28 días, solo tres personas de las que consumieron el paxlovid requirieron hospitalización y fueron dados de alta recuperados; mientras que del grupo con placebo 27 fueron hospitalizados y 7 fallecieron. Posteriormente se hizo otro estudio con 1.881 voluntarios, en el que también se obtuvo una tasa de solo 2,1 % de efectos adversos.
Por su parte, MSD y Ridgeback Biotherapeutics aplicaron también su prueba en 775 pacientes recientemente contagiados. Obtuvieron una tasa de 7,3 % de ingresos al hospital sin muertes, frente a 14,1 % de ingresos y 8 decesos en el grupo placebo. Finalmente los estudios preliminares arrojaron una eficacia de 50 % del molnupiravir para reducir el riesgo de muerte u hospitalización.
Hasta el momento estos datos solo han sido publicados por ambas farmacéuticas en comunicados. Aún falta el resultado de investigaciones independientes realizadas por las autoridades sanitarias y avaladas por revistas científicas reconocidas.
¿Para quiénes serán las píldoras?
Aunque Pfizer tiene la expectativa de que su medicamento pueda ser prescrito como un tratamiento en casa, la verdad es que ambas píldoras están lejos de ser vendidas libremente en farmacias. Por ejemplo, el molnupiravir posee una autorización de uso de emergencia de la Agencia Reguladora de Medicamentos de Reino Unido (MHRA). Es decir, que puede aplicarse aún sin una aprobación oficial, en casos donde no se tenga otra alternativa y bajo estricta supervisión médica.
La MHRA hasta ahora reconoce la eficacia del molnupiravir en pacientes inmunodeprimidos o que poseen un factor de riesgo asociado que puede complicar la enfermedad. En este caso, condiciones como cardiopatías, obesidad y diabetes, o personas de edad avanzada. Por el momento no se plantea su uso para personas contagiadas sin padecimientos previos.
El fármaco fue aprobado para su aplicación en casos leves y moderados, apenas resultan positivos en el test de detección. Un punto a su favor es que si bien requiere supervisión, puede tomarse en casa con una dosis cada 12 horas.
¿En qué se diferencia del tratamiento habitual?
Dada la irrupción sorpresiva del covid-19 en el mundo, el hallar tratamientos efectivos para atender a los pacientes se ha basado en la experimentación, ensayo y error. Múltiples medicamentos han mostrado diferentes grados de efectividad, la mayoría basados en el mismo principio de inhibir la replicación del SARS-CoV-2 para reducir la carga viral en el organismo.
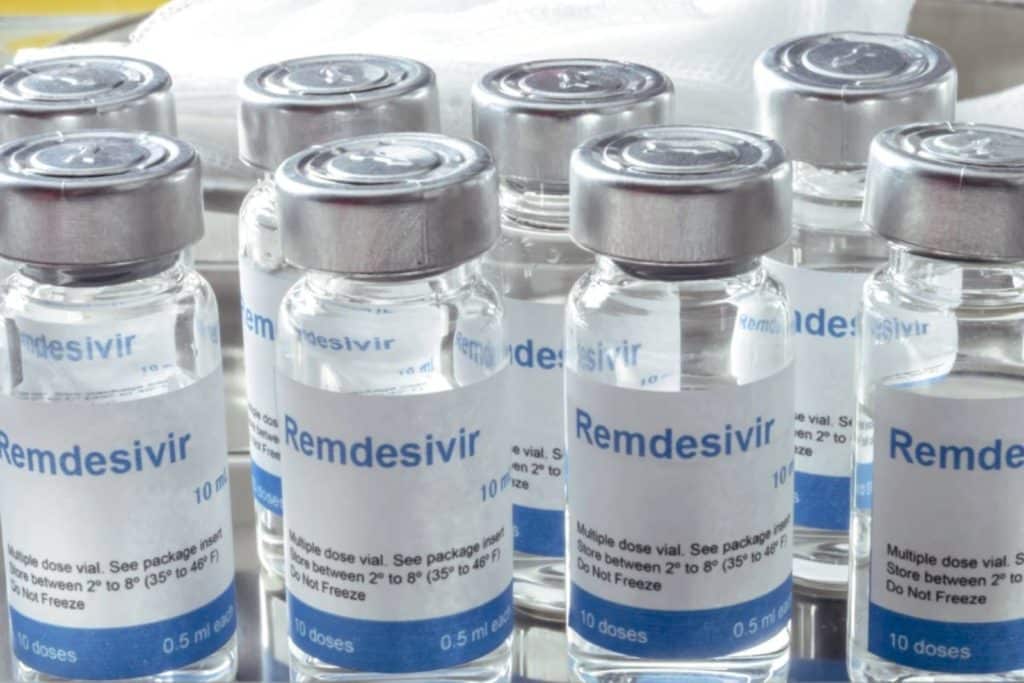
Aún hoy no existe un consenso universal para la aplicación de un tratamiento único. Básicamente emplea diversos cócteles de fármacos basados en sus propias experiencias y circunstancias. Por ejemplo, la Organización Mundial de la Salud (OMS) recomienda la combinación de los anticuerpos monoclonales casirivimab e imdevimab. Ambos fueron aprobados para su uso de emergencia en Estados Unidos, luego de ser utilizados para tratar al entonces presidente Donald Trump. No obstante, la Administración de Alimentos y Medicamentos (FDA) de ese país hasta ahora solo tiene al remdesivir.
El remdesivir se usa ampliamente en el mundo como tratamiento, a pesar de tener algunos efectos secundarios como anemia o descenso del filtrado glomerular. De acuerdo con la Clínica Mayo, otros antivirales como el antiinflamatorio baricitinib también se han aprobado de emergencia para pacientes conectados a respiradores artificiales o que requieran oxígeno. También advirtió que el uso de lopinavir y el ritonavir está contraindicado, al comprobarse que no es eficaz contra el virus.
Otros países, entre ellos Venezuela, han abogado por el uso de la hidroxicloroquina y el interferón. Ambos compuestos demostraron tener altas tasas de efectividad para inhibir el covid-19 en las pruebas in vitro; sin embargo, en la práctica el interferón no ha demostrado la misma capacidad para combatir el virus en pacientes, mientras que los resultados de la hidroxicloroquina son tan cuestionables que todavía mantienen dividida a la opinión médica.
La principal diferencia entre los fármacos de Pfizer y MSD con respecto a los anticuerpos monoclonares usados actualmente radica en la forma de aplicación. Todos los tratamientos actuales se administran por vía intravenosa, lo que en muchos casos requiere la atención de personas capacitadas. En el caso de las píldoras, pueden se pueden recetar de inmediato y solo necesitan un vaso con agua para ingerirlas. “Es el primer antiviral en el mundo que se aprueba para esta enfermedad y que puede tomarse oralmente en lugar de administrarse por vía intravenosa”, declaró a la BBC la directora de la MHRA, June Raine.
El futuro de las píldoras
Además de Pfizer y MSD, otras compañías están en la carrera para desarrollar sus propias pastillas contra el covid-19. Recientemente la empresa Atea Pharmaceuticals, en conjunto con Roche, mostraron los resultados de su medicamento, aunque no con buenos resultados. Si bien obtuvo un buen desempeño en pacientes de alto riesgo, su compuesto no mostró la eficiencia esperada en casos leves y moderados, por lo que la empresa decidió postergar la publicación de sus estudios preliminares y volver a la fase 2 de ensayos.
Por su parte, Pfizer apuesta por el paxlovid y ya envió los resultados de sus pruebas a la FDA en la espera de obtener su autorización. Las autoridades estadounidenses también tienen pendiente evaluar el molnupiravir, que ya inició su proceso de aprobación en Europa. La Agencia Europea del Medicamento (EMA) anunció que acelerará lo más pronto posible su veredicto.
Mientras tanto, ya MSD comenzó a recibir los primeros pedidos de su fármaco. El gobierno de Joe Biden autorizó la compra de 1,7 millones de tratamientos completos, con un costo de 700 dólares cada uno. Aunque el precio pueda causar alertas, la empresa firmó también un acuerdo para liberar la licencia del molnupiravir y permitir la fabricación de genéricos de menor costo. Ya establecieron incluso conversaciones para iniciar su producción con industrias de la India, Estados Unidos y Europa.
Con este panorama, la vacunación se mantiene como la principal manera de preservar la salud durante la pandemia. No obstante, con una población inmunizada y la disponibilidad de medicamentos prescritos para tratar los síntomas, se mantiene la esperanza de que en el futuro el covid-19 se pueda tratar con solo ir a la farmacia.