- El fármaco, desarrollado por la empresa británica Astrazeneca, ha demostrado buenos resultados para pacientes oncológicos, trasplantados, mayores crónicos, pluripatológicos, entre otros, con el sistema inmunológico débil
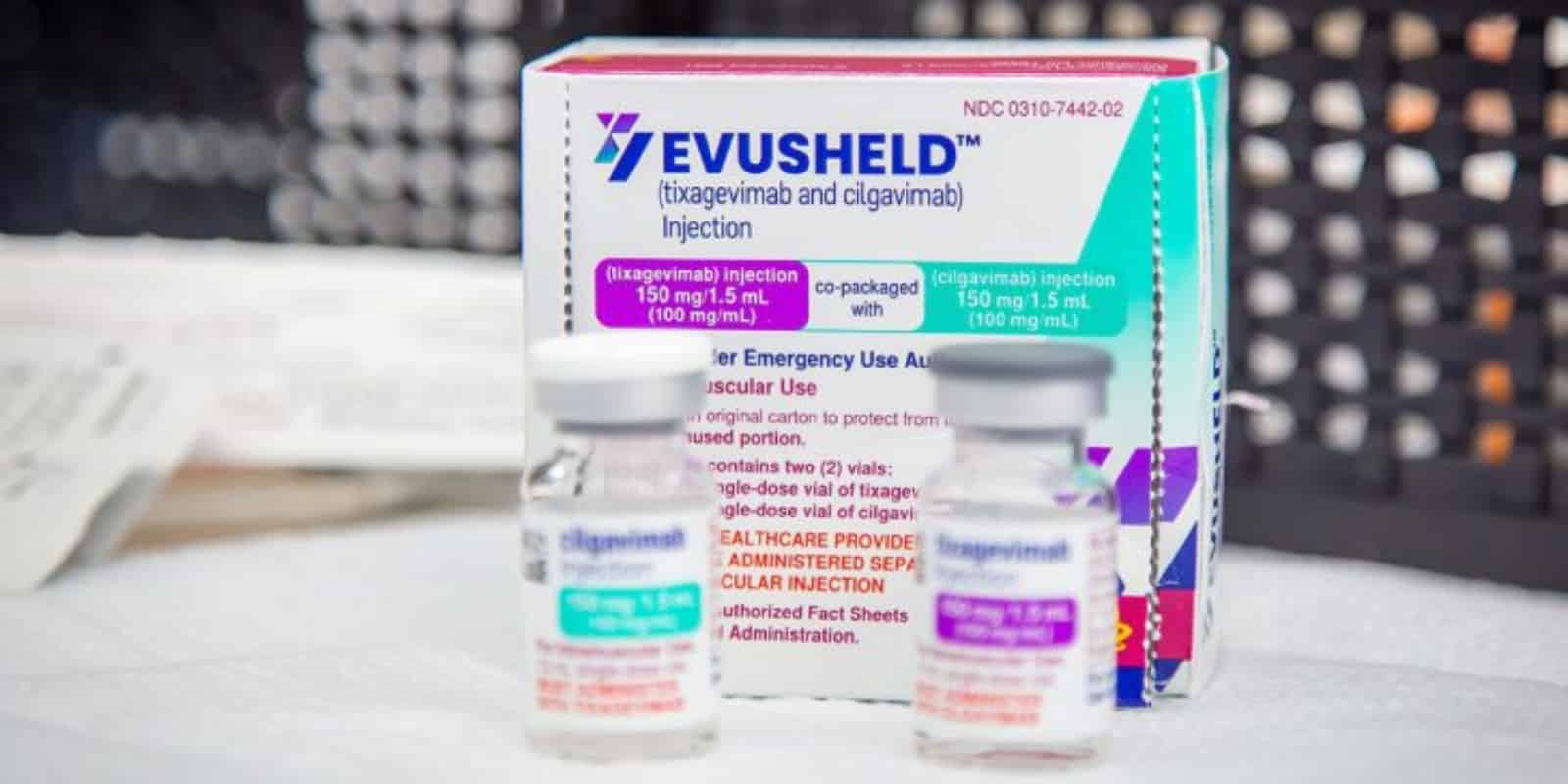
Las compañías farmacéuticas siguen dando pasos agigantados en la lucha contra el covid-19. El avance más reciente pone el foco en los inmunodeprimidos o, lo que es lo mismo, en las personas con un sistema inmunológico débil: se trata de la terapia Evusheld, de Astrazeneca, que surge como una alternativa para las vacunas contra el virus. Cada vez son más los países que se interesan en adquirirlas.
Evusheld es una combinación de dos anticuerpos monoclonales de larga duración (tixagemivab y cilgamivad). Se administra como una dosis intramuscular de 150 mg de tixagemivad y 150 mg de cilgamivad, en dos inyecciones consecutivas separadas.
Su función principal es prevenir el covid-19, ya que puede restaurar, mejorar o imitar el ataque del sistema inmunitario a los patógenos. Es decir, está diseñado para bloquear la adhesión viral y la entrada en células humanas, neutralizando de esta forma el virus. Ya ha mostrado una actividad neutralizante contra la variante ómicron y todas las demás variantes del covid-19, según un estudio del University College Oxford y de la Facultad de Medicina de la Universidad de Washington.
“En el ensayo Provent, 3.441 personas recibieron Evusheld y 1.731 recibieron un placebo. En el análisis primario, los destinatarios de Evusheld vieron un 77 % de riesgo reducido de desarrollar covid-19 en comparación con aquellos que recibieron un placebo. En análisis adicionales, la reducción en el riesgo de desarrollar coronavirus fue mantenido para los beneficiarios de Evusheld durante seis meses”, destacan, por otra parte, desde Astrazeneca.
¿Por qué es importante?
El tratamiento ya cuenta con la aprobación de la Administración de Medicamentos y Alimentos de Estados Unidos (FDA, por sus siglas en inglés). Por ahora, la FDA aprobó su uso para evitar el covid-19 en adultos y niños con profilaxis previa. Al igual que sucede con las vacunas, las personas que quieran recibir el fármaco no deben estar infectados por el virus ni haber estado en contacto reciente con un caso positivo de covid-19.
Para la FDA, quienes reciben Evusheld deben tener un “compromiso inmunológico de moderado a severo debido a una condición médica o recibo de medicamentos o tratamientos inmunosupresores y no puede crear una respuesta inmune adecuada a la vacuna covid-19 o no se les recomienda esta inoculación por un historial de reacciones adversas graves”.

Es decir, en ese grupo entran pacientes oncológicos, trasplantados, mayores crónicos, pluripatológicos, entre otros, con la inmunidad comprometida; así como en pacientes vulnerables que únicamente con la vacunación no consiguen llegar a niveles de protección suficiente para “normalizar” su actividad inmunológica.
Esto beneficia particularmente al 2 % de la población mundial que sufre el riesgo de una respuesta inadecuada a las vacunas contra el covid-19.
No obstante, Evusheld debe considerarse únicamente como una alternativa para la vacuna en los casos mencionados.
Astrazeneca subraya que el tratamiento no está autorizado para tratar el covid-19 como tal y se recomienda la vacunación contra el virus en todos los casos que se puedan. Sin embargo, las personas vacunadas con una sola dosis de la vacuna podrían recibir el fármaco, aunque tendrían que esperar al menos dos semanas para que no reduzca la respuesta inmunitaria.
¿Qué países la han adquirido?
El gobierno de Estados Unidos adquirió, en principio, 700.000 dosis de Evusheld. Pero en enero la Administración de Joe Biden compró otras 500.000 dosis adicionales.
En Europa, mientras que el Comité de Medicamentos Humanos de la EMA (CHMP) está evaluando los datos de los ensayos clínicos para solicitar su autorización en Europa, el gobierno de España pidió recientemente 30.000 dosis de estos antivirales, los cuales llegarán a ese país durante el mes de febrero.
La ministra de Sanidad española, Carolina Darias, dijo el viernes 4 de febrero que España añadirá estas dosis al portafolio de medicamentos monoclonales que está elaborando el ministerio “para seguir salvando vidas”.