- En lo que va de año, se han reportado seis alertas por productos no aptos para el consumo humano
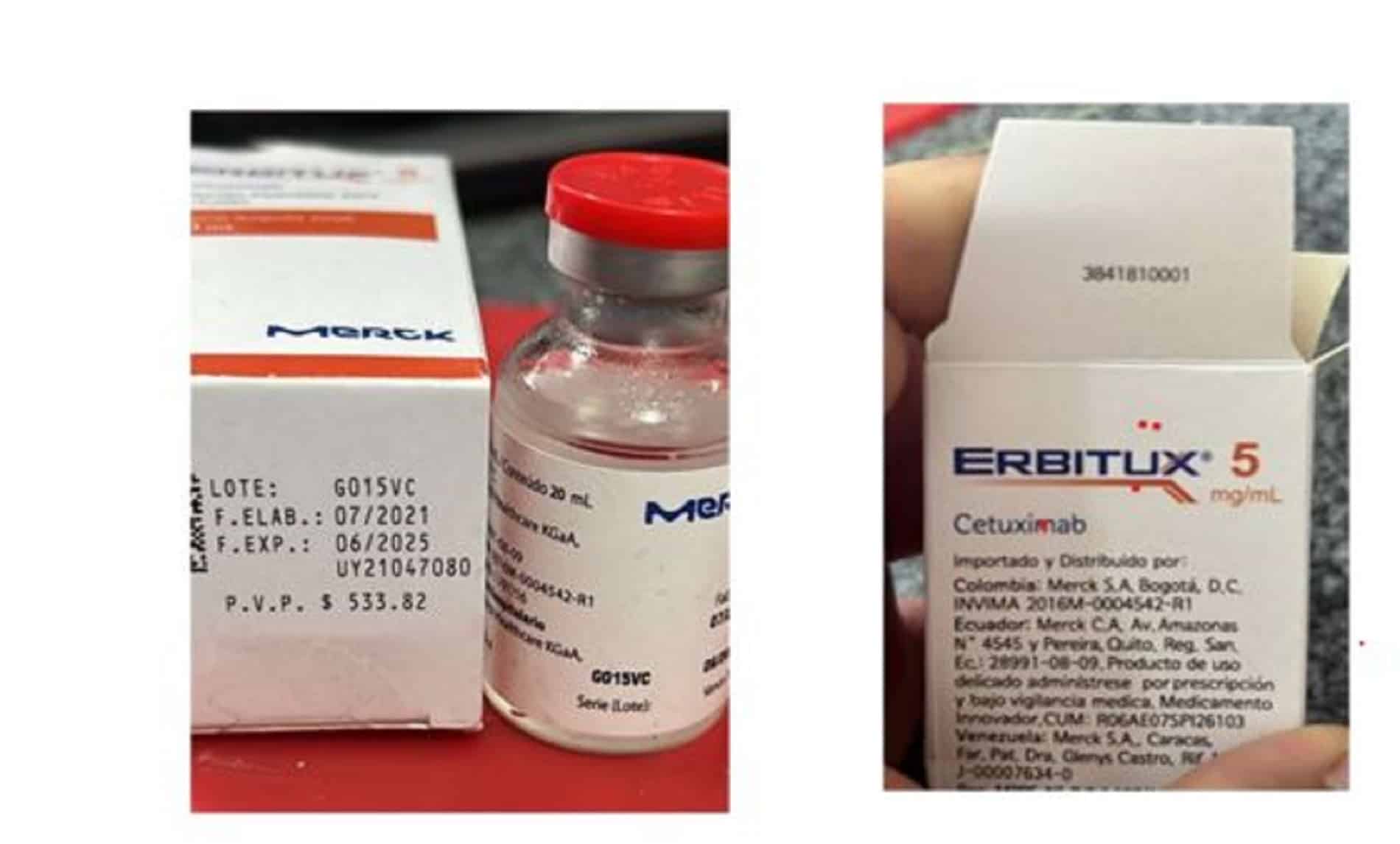
El Instituto Nacional de Higiene Rafael Rangel (INHRR) informó recientemente a través de la alerta sanitaria Nº 006/2023 sobre la comercialización de un lote de Erbitux (Cetuximab), identificado con el número G015VC, no apto para el consumo humano.
El organismo de salud indicó que la denuncia la realizó el representante de Erbitux en Venezuela, Merck, S.A., quien manifestó que el producto falsificado fue adquirido presuntamente a través de un distribuidor en Colombia.
Asimismo, informó que la empresa representante indicó que un lote fabricado por Merck Healthcare KGaA (Alemania), con el mismo número del cuestionado, se distribuyó en Ecuador. Además, detalló que Erbitux (Cetuximab) 5 mg / ml solución inyectable p.b.1.197/21, no se está comercializando en el país.
El INHRR recomendó a la ciudadanía no adquirir el medicamento hasta que no se compruebe su legalidad.

Agregó que si alguien lo está utilizando, debe suspender de inmediato su uso debido a los riesgos que puede representar para la salud, y denunciar los lugares o personas que lo distribuyen o comercialicen a través del correo electrónico alertasinhrr@gmail.com.
Erbitux se utiliza para el tratamiento del cáncer metastásico de colon o recto (intestino grueso), y para tratar cáncer de células escamosas de cabeza y cuello.
Albúmina Humana
El Instituto Nacional de Higiene Rafael Rangel también alertó a mediados de octubre sobre la venta de Albúmina Humana no apta para su uso y consumo humano.
En esa oportunidad, precisó en la alerta sanitaria Nº 005/2023 que el lote del producto biológico Albúmina Humana 200 g / l solución intravenosa p.b. 912/20, fue identificado con el número 233517.
“Consultada la empresa Kedrion (fabricante del producto original), a través de su representante en Venezuela, Medifarm Inversiones y Representaciones, C.A., acerca del lote nº 233517, manifestó que dicho lote no consta en su historial de fabricación ni corresponde a la numeración que utiliza kedrion para la albúmina”, acotó.
En la alerta precisaron que luego de realizar pruebas de control de calidad a las muestras cuestionadas, determinaron la ausencia de principio activo y ph fuera de especificaciones analíticas, por lo que concluyeron que el medicamento no es apto para su uso y consumo porque presenta un riesgo para la salud de la población.
La Albúmina Humana se administra para restablecer y mantener el volumen de sangre circulante en pacientes cuando se ha demostrado una deficiencia de volumen.
Otras denuncias

El Instituto Nacional de Higiene Rafael ha registrado seis alertas sobre medicamentos falsificados y presuntamente falsificados en lo que va del año.
En el mes de septiembre denunció la comercialización de un lote de Suero Antiofídico Polivalente en solución intravenosa, identificado con el número 191. En esa ocasión también refirió que al realizar las investigaciones determinaron que no es apto para el consumo humano.
En julio advirtió sobre la falsificación de un producto de uso pediátrico: Atamel 100 mg/ml en solución en gotas en su presentación de 30 mL, identificado con el número L8771.
Los otros dos productos que recibieron alertas fueron Mentol Davis Ungüento E.F. 537/17, en presentación de 14,18 gramos. Y los lotes N3924B02 y N3927 de Herceptin de 440 miligramos, en polvo liofilizado para infusión intravenosa P.B. 1.164/20 que no tenían el principio activo Trastuzumab.
“Se comunica a la población que este producto es dispensado en la actualidad, únicamente, por las farmacias del Banco de Drogas Antineoplasicas Badan (Fundación Badan), si es adquirido fuera de las farmacias señaladas, notifique al Inhrr a través de la página web http://inhrr.gob.ve, o al correo electrónico alertasinhrr@gmail.com para validar su autenticidad”, puntualizaron.