- El regulador europeo indicó que el objetivo es usar una dosis más pequeña y así hacerle frente al brote actual
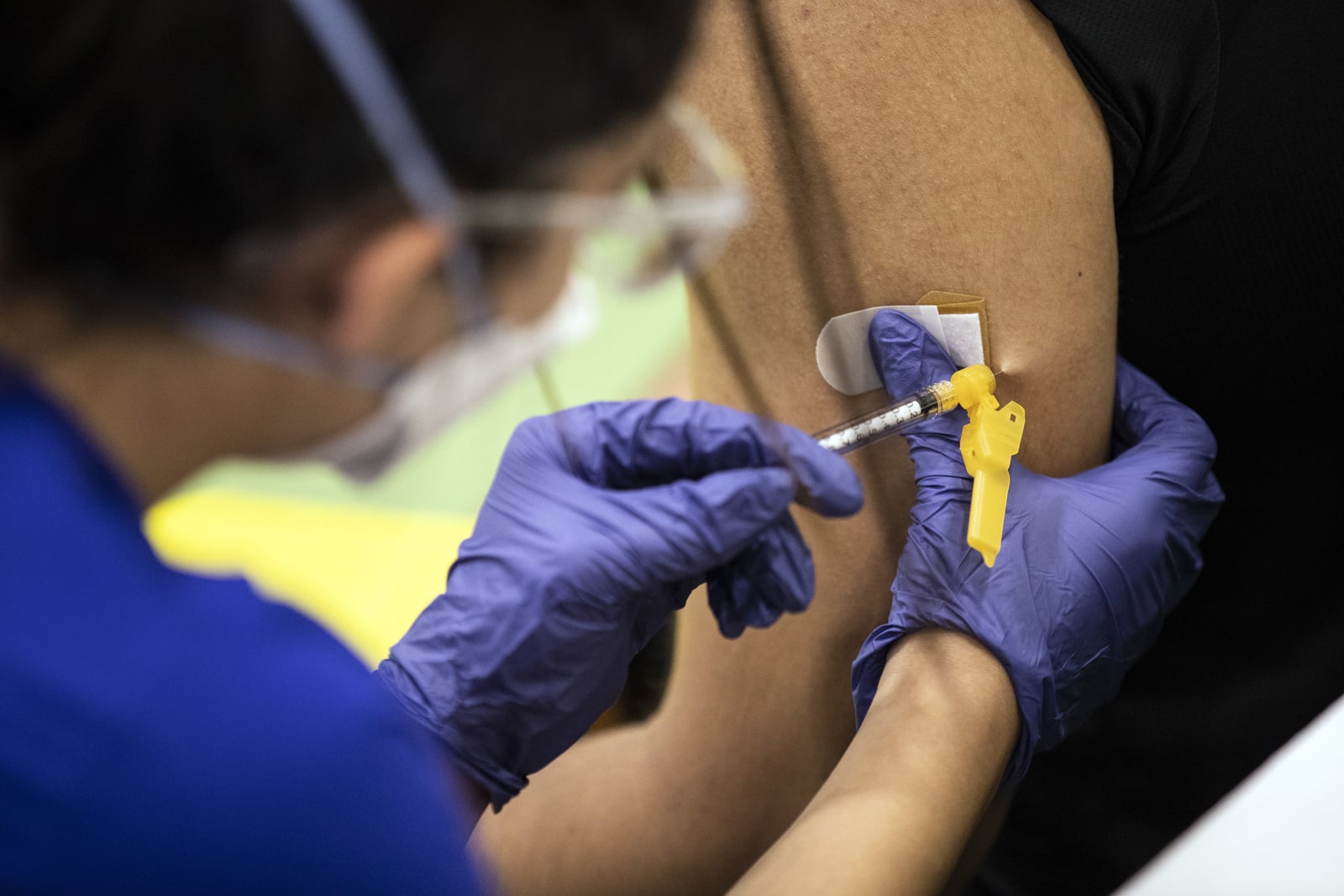
La Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) recomendó el uso intradérmico (dosis administrada debajo de la capa superior de la piel) de la vacuna Imvanex contra la viruela del mono, en lugar de como inyección subcutánea (debajo de la piel).
El grupo de trabajo de emergencias (ETF, por sus siglas en inglés) de la EMA ha revisado los datos sobre la vacuna contra la viruela del mono Imvanex utilizada como inyección intradérmica. Sostuvo que cuando se administra por esa vía se puede usar una dosis más pequeña de la vacuna.
“Dado el suministro limitado actual de la vacuna (que está autorizado en la Unión Europea como dosis subcutánea), esto significa que se puede vacunar a más personas”, indicó el regulador europeo en un comunicado.
La EMA indicó que esta recomendación es una “medida temporal para proteger a las personas en riesgo durante el brote actual de viruela del mono mientras el suministro de la vacuna siga siendo limitado”.
Detalles de los ensayos clínicos
La agencia indicó que la ETF revisó los datos de un ensayo clínico en el que participaron aproximadamente 500 adultos, que comparó la vacuna Imvanex administrada por vía intradérmica o subcutánea, en dos dosis con un intervalo de cuatro semanas entre cada inyección.
“Las personas que recibieron la vacuna por vía intradérmica recibieron una quinta parte (0,1 ml) de la dosis subcutánea (0,5 ml). Pero produjeron niveles de anticuerpos similares a los que recibieron la dosis subcutánea más alta”, detalló la EMA.
Sin embargo, advirtió que existe un mayor riesgo de reacciones locales -como enrojecimiento más duradero y engrosamiento o decoloración de la piel- después de las inyecciones intradérmicas.
La ETF indicó que no hay información disponible sobre el número máximo de dosis de 0,1 ml que se pueden obtener de la presentación autorizada (suspensión de 0,5 ml). En este sentido, recomendó utilizar jeringas de bajo volumen para optimizar el número de dosis que se pueden extraer. ecomendó el uso intradérmico (dosis administrada debajo de la capa superior de la piel) de la vacuna Imvanex
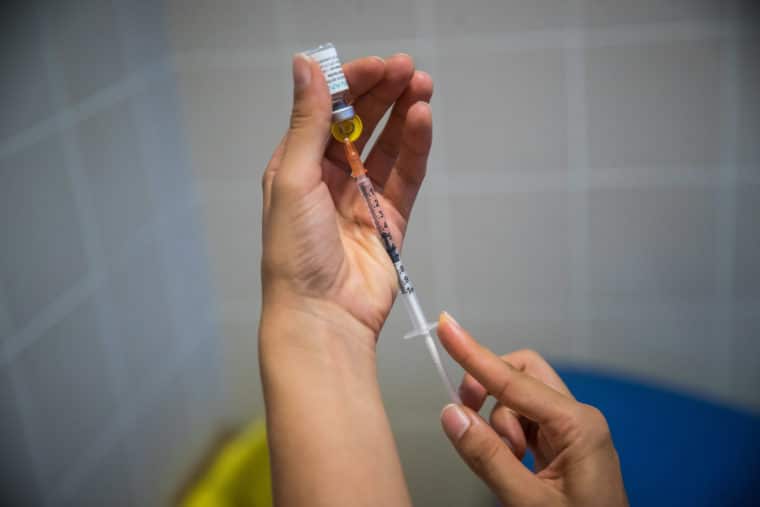
Además, enfatizó la importancia de administrar las inyecciones intradérmicas correctamente. Recomendó que solo los profesionales de la salud con experiencia en la administración de inyecciones intradérmicas deberían administrar la vacuna Imvanex de esta manera.
La EMA indicó que teniendo en cuenta todas estas consideraciones, las autoridades nacionales pueden decidir utilizar Imvanex como una inyección intradérmica en una dosis más baja como medida temporal para proteger a las personas en riesgo durante el brote actual de viruela del mono mientras el suministro de la vacuna sigue siendo limitado.
Una medida para dar respuesta a una emergencia de salud
La agencia de medicamentos sostuvo que el consejo de la ETF se ha emitido para abordar el brote de viruela símica en varios países de la Unión Europea “en el contexto de sus actividades de respuesta a emergencias de salud pública”. Las cuales incluyen dar consejos para respaldar las actividades y las evaluaciones relacionadas con los productos.

Kyriakides subrayó que la medida asegurará un mayor acceso a la vacunación para los ciudadanos en riesgo y los trabajadores de la salud. Agregó que Bruselas seguirá coordinando su respuesta a este brote con los Estados miembros en las próximas semanas y meses.
La EMA recordó que la vacuna Imvanex se autorizó por primera vez en circunstancias excepcionales en 2013 para la protección contra la viruela. No obstante, tras una solicitud para ampliar su uso, se autorizó para proteger contra la viruela del simio el 22 de julio de 2022.